Błony biologiczne stanowią trudną do sforsowania barierę dla większości substancji rozpuszczalnych w wodzie, w tym zwłaszcza dla cząstek obdarzonych ładunkiem. Tymczasem wiele cząsteczek leków posiada w swojej strukturze łatwo jonizowalne grupy funkcyjne i w pH fizjologicznym występuje w postaci jonów ujemnych. Spowalnia to znacząco ich przenikanie do wnętrza komórek, co z kolei może osłabiać ich działanie, np. przeciwnowotworowe czy przeciwbakteryjne. Syntetyczne transportery anionów, czyli niewielkie, lipofilowe cząsteczki organiczne ułatwiające przenikanie anionów przez bariery lipofilowe, mogłyby pomóc w rozwiązaniu tego problemu przyspieszając migrację leków anionowych przez membrany lipofilowe. Co więcej, transportery takie potrafią reagować na bodźce, takie jak zmiana pH, obecność enzymów czy naświetlanie światłem o określonej długości fali, i dzięki temu mogłyby umożliwić kontrolę nad dostarczaniem leków we właściwe miejsce i w odpowiednim czasie.
W ramach naszego nowego grantu zamierzamy opracować przełączalne transportery molekularne dla leków anionowych. Cząsteczki takie mogłyby być przydatne m.in. w walce z lekoopornymi bakteriami i nowotworami, które należą do najpoważniejszych współczesnych zagrożeń dla zdrowia publicznego. Ponadto, opracowane przez nas transportery mogłyby też pomóc w komercjalizacji substancji aktywnych o słabej biodostępności, ograniczaniu skutków ubocznych szczególnie toksycznych leków i w zwalczaniu lekooporności.
Jeśli podobają Ci się te pomysły, dołącz do nas i pomóż nam je zrealizować! Zapraszamy przyszłych studentów studiów magisterskich i doktoranckich, a także młodych uczonych z doktoratem, do kontaktu z prof. Michałem Chmielewskim pod adresem: mchmielewski@chem.uw.edu.pl
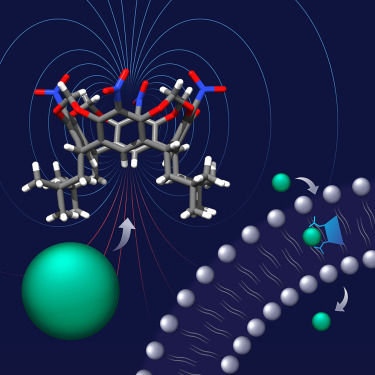
We współpracy z zespołem prof. Agnieszki Szumnej z Instytutu Chemii Organicznej PAN wykazaliśmy, że rezorcyn[4]areny, tradycyjnie uznawane za receptory kationów, można w prosty sposób przekształcić w receptory i transportery anionów. Zmodyfikowane rezorcyn[4]areny wykorzystują wiązania wodorowe CH–anion – powszechnie uważane za słabe – do silnego wiązania anionów. Jest to możliwe dzięki unikalnym cechom geometrycznym tych receptorów, które pozwalają im wytworzyć duże momenty dipolowe (nawet 15,8 D) i skoncentrować wysoce dodatni potencjał elektrostatyczny w jednym punkcie.
Co więcej, pokazaliśmy również, że proste wstawienie grup alkilowych w pobliże miejsca wiążącego aniony sprawia, że receptory stają się wyjątkowo odporne na wodę i aktywne w transporcie anionów przez dwuwarstwy lipidowe. Na przykład aktywność receptora 2 w wymianie Cl–/NO3– przewyższa aktywność wszystkich wcześniej opisanych transporterów wiążących aniony wiązaniami CH. Rezorcyn[4]aren 2 wykazuje również niezwykłą selektywność w eksperymentach związanych z transportem anionów: Cl− > OH−. Dzieje się tak prawdopodobnie ze względu na miękki charakter donorów CH i ich odporność na deprotonowanie. Taka selektywność jest wysoce pożądana w zastosowaniach medycznych, ponieważ minimalizuje toksyczność transporterów.
Synteza templatowana anionami nie jest już ograniczona do katenanów i rotaksanów naładowanych elektrycznie. Dzięki zastosowaniu w charakterze templatu anionów siarczanowych oraz dzięki blokom budulcowym o wyjątkowo silnym powinowactwie do siarczanów udało nam się otrzymać fluorescencyjny katenan czuły na aniony siarczanowe, zdolny do ich nadzwyczaj mocnego wiązania nawet w środowisku o dużej zawartości wody. Co więcej, pokazaliśmy, że anion siarczanowy jest templatem przełączalnym przy pomocy zmian pH, i że dzięki temu można go zastosować do przełączania katenanu pomiędzy dwoma znacznie różniącymi się stanami.
Czy zastanawiałeś/łaś się kiedyś, dlaczego post-syntetyczna modyfikacja MOF-ów tak często daje niskie wydajności i jest nieodtwarzalna? Nasza najnowsza praca w MSDE oferuje możliwe rozwiązanie tych problemów.
Postsyntetyczna modyfikacja MOF-ów (z ang. PSM) to bardzo użyteczny sposób wprowadzania złożonych funkcjonalności do szkieletów metaloorganicznych (MOF). MOF-y z grupami aldehydowymi są szczególnie atrakcyjnymi substratami dla PSM ze względu na wysoką reaktywność grup aldehydowych, ale ta sama cecha sprawia również, że ich solwotermalna synteza jest trudna. W naszej pracy pokazujemy, że choć obniżenie temperatury podczas syntezy UiO-68 z grupami aldehydowymi pozwala na uniknięcie degradacji grupy aldehydowej i daje wysoce porowaty oraz krystaliczny materiał, to jednak powstający w ten sposób UiO-68-CHO zawiera dużo defektów w postaci brakujących linkerów, i w rezultacie jego PSM jest zarówno niskowydajna, jak i niepowtarzalna. Pokazujemy również, że problem ten można rozwiązać przez 1) użycie nadmiaru łącznika podczas syntezy MOF-a i 2) moczenie surowego materiału w roztworze łącznika, dzięki czemu można obniżyć gęstość defektów na tyle, żeby otrzymać doskonały substrat dla PSM. Traktowanie takiego „uleczonego” materiału modelowymi aminami daje niemal ilościowe konwersje grup aldehydowych do imin, bez konieczności stosowania nadmiaru reagentów. Co ważne, PSM „wyleczonego” UiO-68–CHO daje powtarzalne wyniki przez wiele dni, w przeciwieństwie do PSM wysoce zdefektowanego materiału. Dzięki tym osiągnięciom z powodzeniem wprowadziliśmy do struktury UiO-68 różnorakie funkcje, takie jak nowe miejsca koordynacyjne, cząsteczki leków, chiralność i hydrofobowość. Szkodliwy wpływ defektów na PSM MOF-ów oraz proponowane przez nas rozwiązanie tego problemu mogą mieć charakter ogólny, a zatem mogą pomóc w opracowaniu nowych, użytecznych platform do kowalencyjnej PSM.
Serdeczne gratulacje dla naszej doktorantki, Krystyny Maslowskiej-Jarzyny, która została wybrana do grona 100 najwybitniejszych młodych polskich uczonych, jako jedna z zaledwie 10. chemików z całej Polski i jako jedyna przedstawicielka naszego Wydziału! Fundacja na rzecz Nauki Polskiej wybiera stypendystów programu START w drodze wieloetapowego konkursu, w którym oceniana jest jakość ich dotychczasowego dorobku naukowego.
Więcej informacji na stronach Fundacji.
Opracowaliśmy nową strategię projektowania syntetycznych transporterów aminokwasów, czyli niewielkich cząsteczek organicznych zdolnych do efektywnego przenoszenia aminokwasów przez dwuwarstwy lipidowe. Takie związki mogą wykazywać szerokie spektrum aktywności biologicznych a także znaleźć zastosowania w transporcie leków, regulacji metabolizmu czy też jako antybiotyki nowej generacji.
Transport aminokwasów przez błony biologiczne jest procesem kluczowym dla funkcjonowania każdej żywej komórki. Wynika to z faktu, że w pH fizjologicznym aminokwasy są bardzo polarne (mają dodatnio naładowany N-koniec i ujemnie naładowany C-koniec) i z tego powodu nie są w stanie samodzielnie przeniknąć przez dwuwarstwy lipidowe. W naturze transportem aminokwasów zajmują się wyspecjalizowane białka membranowe, które odgrywają ważną rolę w regulacji kluczowych funkcji fizjologicznych, takich jak biosynteza białek, metabolizm, ekspresja genów, równowaga redoks i przekazywanie sygnałów. Dysfunkcja tych białek przyczynia się do rozwoju poważnych chorób, takich jak cukrzyca, choroby neurodegeneracyjne, otyłość i nowotwory. Syntetyczne transportery aminokwasów mogłyby pomóc w leczeniu tych chorób, a także posłużyć jako nośniki leków, regulatory metabolizmu a nawet jako antybiotyki nowej generacji.
Niestety, właśnie ze względu na obojnaczy charakter aminokwasów, będących jednocześnie kationami i anionami, opracowanie takich syntetycznych transporterów było dotychczas zadaniem niezwykle trudnym, wymagało bowiem połączenia w jednej strukturze miejsc wiążących kationy i aniony. W niniejszej pracy pokazujemy jednak, że takie podejście nie jest jedynym możliwym i że nawet bardzo proste transportery anionów są w stanie efektywnie przenosić aminokwasy przez dwuwarstwy lipidowe w pH fizjologicznym. Aby wyjaśnić tę nadspodziewaną skuteczność prostych anionoforów, opracowaliśmy nową metodę badania transportu aminokwasów, która dała nam wgląd w mechanizm tego zjawiska. Dzięki temu byliśmy w stanie zaproponować nową strategię poszukiwania syntetycznych transporterów aminokwasów o ulepszonych właściwościach i interesującej aktywności biologicznej. Czytaj dalej tutaj.
Nasze badania ujawniły współzawodnictwo dwóch różnych mechanizmów transportu HCO3‾ przez proste di(tio)amidokarbazole, a także silne działanie antybakteryjne tych związków. Przeczytaj więcej tutaj.
Aniony są przeważnie zbyt hydrofilowe, żeby mogły swobodnie przenikać przez błony biologiczne. Dotyczy to również tych leków, które w pH fizjologicznym występują w postaci anionowej. Syntetyczne transportery anionów, czyli niewielkie, lipofilowe cząsteczki organiczne ułatwiające przenikanie anionów przez bariery lipofilowe, potrafią przyspieszać dyfuzję anionów przez dwuwarstwy lipidowe o wiele rzędów wielkości i dzięki temu mogłyby radykalnie zwiększyć skuteczność działania leków o charakterze anionowym. Co więcej, transportery, których aktywnością można sterować przy użyciu światła, pH lub innych bodźców, mogłyby umożliwić celowane dostarczanie leków w odpowiednie miejsce i w odpowiednim czasie. Celem niniejszego projektu jest opracowanie pierwszych przełączalnych transporterów molekularnych dla leków anionowych i zademonstrowanie w ten sposób nowego sposobu sterowania dostarczaniem leków. W jego ramach podejmiemy badania nad konstrukcją transporterów przełączalnych przy pomocy zmian pH albo naświetlania światłem o określonej długości fali. Mamy nadzieję, że badania te zaowocują powstaniem nowej strategii inteligentnego dostarczania leków, która może w przyszłości znaleźć praktyczne zastosowanie np. w leczeniu nowotworów.
Debashis ukończył chemię na IIT Bombay (Indie) w 2015, a następnie doktorat z chemii supramolekularnej anionów w IISER Pune (Indie) pod kierunkiem prof. Pinaki’ego Talukdara (2022). We wrześniu 2022 dołączył do Laboratorium Chemii Supramolekularnej jako badacz wizytujący (post-doc) w celu realizacji grantu NCN OPUS pt. “Selektywny transport anionów o znaczeniu biologicznym przez dwuwarstwy lipidowe”.
Twitter: https://twitter.com/DebashisJMChem
Serdecznie witamy!
Poszukujemy postdoków do pracy przy realizacji projektu badawczego z pogranicza chemii organicznej, medycznej i supramolekularnej.
Celem projektu jest poszukiwanie cząsteczek zdolnych do selektywnego transportu anionów o znaczeniu biologicznym przez dwuwarstwy lipidowe. Cząsteczki takie mogą wykazywać właściwości antynowotworowe, antybakteryjne i antywirusowe, a także znaleźć zastosowanie w leczeniu chorób wynikających z dysfunkcji naturalnych transporterów w organizmie. W ramach projektu chcielibyśmy też skonstruować transportery przełączalne przy pomocy bodźców zewnętrznych, takich jak pH, światło czy potencjał redoks.
Osoby zatrudnione w grancie będą się zajmować projektowaniem, syntezą i badaniem właściwości kompleksotwórczych nowych receptorów molekularnych na aniony, a także badaniem ich zdolności do transportowania anionów przez dwuwarstwy lipidowe modelowych liposomów.
Oferujemy:
Termin nadsyłania zgłoszeń: 16 lipca 2022. Szczegóły procedury rekrutacyjnej w Ogłoszeniu.